[Cap au seuil|Sommaire rapide] Avant propos | espace | la vie | monde | les écologies | cénologie | sciences naturelles | interlude | protection de la nature | arbres | anthropocène | catastrophe | herbier/coquillier | ouverture : régions naturelles
La vie < Terraqué le monde (2) > Deux (ou trois) écologies
Texte publié le 18 avril 2020, mis à jour pour la dernière fois le 30 août 2025 (43 révisions).
Dans la nature tout est dans tout. Tout est métamorphose incessante.
Pour en jouir, il faut avoir la faculté de lui imposer des limites qui n’y sont point.
L’art introduit cette division dans le domaine du beau, permet de fixer notre attention.
Jean Paulhan, inédit
L’écologie se pense donc aussi bien sur la géographie (et ses savoirs dérivés) que sur la biologie (et ses savoirs dérivés), elle est très exactement un savoir charnière, la fille des deux autres, et il n’est pas du tout étonnant, de fait, de constater que les premiers pas de la jeune science soient le fait de biogéographes (phytogéographes, en effet, dès l’abord). L’exploration des origines de l’écologie fera l’objet d’un chapitre ultérieur.
Pour le moment, cherchons à réduire encore notre champ d’intervention.
Ecozones ou biochores ?
Une autre dimension de la vie sur la terre peut être considérée du point de vue du climat : là encore, la tentation fut forte de proposer une distribution en zonations sur le globe. On doit à Wladimir Köppen une classification des climats en 1900, combinaison de la carte mondiale de végétation de August Grisebach et de la division du climat d’Alphonse de Candolle. Celle-ci, actualisée en 1961 par Rudolf Geiger, reste pertinente aujourd’hui, même si elle a pu être précisée çà et là[1]August Grisebach, « Die Vegetations-Gebiete der Erde, übersichdich zusammengestellt » , in Petermann’s Geographische Mittheilungen n°12/3, post p. 744, 1866 August Grisebach, Die Vegetation … Continue reading. L’observation de la répartition de la biosphère à travers le globe, qui a été l’objet des pionniers de l’écologie que je viens de citer, amène à la conclusion que les différents types de climat produisent, relativement régulièrement, les mêmes types de végétation. C’est précisément l’origine d’une recherche et d’une méthode de la description, classification et dénomination de ces types.
Si l’on observe, cette fois à l’échelle de la biosphère, la distribution des biotes sur le globe, on découvre rapidement de grandes différences, évidentes, et de grands ensembles, remarquables : tout d’abord, liées au découpage précédent (climatique) on repère généralement de grandes portions du globe, les écozones (Miklos Udvardy, en 1975[2]Miklos D.F. Udvardy, « A Classification of the Biogeographical Provinces of the World. Prepared as a contribution to UNESCO’s Man and the Biosphere Programme, Project No. 8. », IUCN … Continue reading), utilisées pour indiquer de grandes répartitions géographiques à l’échelle mondiale (mais cela est essentiellement formé sur les mammifères ou les pantes, et dans un souci de conservation – donc loin de nos préoccupations bioécocénotiques). Elles sont respectivement : la zone Afrotropicale, Antarctique, Australasienne, Indomalaise, Paléarctique, Néarctique, Néotropique, Océanienne. Le simple fait qu’elle serve de base aux classifications du WWF ou de l’Unesco nous laisse entendre qu’elles présentent des caractères qui échappent à notre recherche[3]David Olson & Eric Dinerstein, « The Global 200: A representation approach to conserving the Earth’s most biologically valuable ecoregions », in Conservation Biology n°12, pp. 502–515, … Continue reading.
Plus prosaïquement, en observant les cartes du monde, on le voit tout de suite : les océans, évidemment s’opposent aux terres émergées ; mais là, les déserts s’opposent aux prairies, et ici, les prairies se distinguent des forêts. Ces grands « types de milieu », qu’une espèce de ligne climatique (une espèce de tresse entre isotherme et isohyète) croise avec un certain type de végétation, Köppen déjà les appelle « biochores ».
Lorsque j’ai cherché à décrire les grands Habitats dans le cadre d’un travail sur les cénoses animales (chez les mollusques en particulier), j’ai dû me résoudre à considérer de grands types de milieux qui ne correspondaient pas tout à fait aux habitats de la phytogéographie ou de la phytosociologie : ceux-ci étaient déjà trop détaillés. L’écologue québécois Paul Dansereau reprend ainsi le terme de biochore et le définit comme « the geographical environment where certain dominant life-forms appear to be adapted to a particular conjunction of meteorological factors […] Each biochore is characterized by a major type of vegetation[4]Pierre Dansereau, Biogeography. An Ecological Perspective, Ronald Press Co., 1957. ». Et il décrit quatre grands biochores : la forêt, la savane, la pelouse/steppe (grassland) et le désert. C’est étonnant comme cela fait écho (même imparfait) avec ce que disait le malacologue Ludwig Häßlein, à savoir que les escargots ne connaissaient que quatre grands types d’habitats : l’eau, la roche, les milieux ouverts et les milieux fermés.
En vérité on n’en est pas si éloigné : assurément, l’eau forme un biochore en soi, peut-être même divisible en eaux douces/eaux salées. La roche pure également (comprendre, aussi, les montagnes nues ou les grottes, et le sol lui-même, domaine des lombrics et de la rhizosphère, par exemple, un tiers de la vie mondiale[5]Marc-André Selosse, L’origine du monde, Actes Sud, 2021 ; voir Jean Garbaye, La symbiose mycorhizienne. Une association entre les plantes et les champignons, Quae, 2013. ; on peut peut-être lui ajouter les glaces et neiges éternelles). Pour les milieux structurés par la végétation, assurément la steppe et la forêt représentent deux extrêmes. Le cas de la savane est plus complexe, mais pas si éloigné de celui de la garrigue méditerranéenne. En tout et pour tout, on observe ainsi quatre à six grands habitats, structurellement définis, et faisant donc abstraction des végétations en présence : ce ne sont pas le rattachement des plantes à leur phylogénie qui nous intéresse ici, c’est leur type biologique, tels que définis à l’origine par Christen Raunkiaer (life-form, en anglais, comme disait Dansereau).
Ce premier découpage des grandes régions biogéographiques est utile pour ses qualités structurelles, mais attention : les plantes qui interviennent ici, je le répète, n’ont pas véritablement de valeur en tant qu’espèce, mais en tant qu’élément structurant.
Le saut quantique
Cette dernière remarque me conduit à préciser une notion qui me sera utile également dans le chapitre suivant. À dire le vrai, ce n’est pas exactement une notion, ni même un concept, mais plutôt la description d’un phénomène, difficilement quantifiable, et qui est le fruit d’une longue réflexion, et fruit de nombreuses observations. Cédant à une espèce de facilité qui serait probablement épinglée par une critique ravageuse à la Sokal et Bricmont, je prétends (et assume) toutefois le tour de passe-passe qu’on pourra y déceler. Faisant cela, je ne fais jamais qu’œuvre rhétorique, et précisément à des fins de « divulgation scientifique », si l’on veut, et probablement même afin de tâcher d’expliquer à moi-même ledit phénomène, qui me paraît en outre bien réel, mais inexorablement insensible aux radars traditionnels de la science ou de l’épistémologie.
Ce phénomène, visible en écologie (en écobiocénotique, cf. le chapitre 5), je l’ai dénommé « saut quantique ». En physique moderne, en physique quantique, le « saut quantique » désigne le brusque changement d’état d’un système à un autre état ; dans l’atome par exemple, il y a saut quantique lorsqu’un électron passe brusquement d’un état d’énergie à l’autre – phénomène qui contredit les lois de la physique traditionnelle, qui ne prévoit pas de discontinuité dans la nature : Natura non facit saltum.
Bien évidemment, n’étant pas physicien, les mots que je viens d’énoncer me paraissent tout au plus intelligibles, mais je n’ai aucune représentation de ce que cela peut vouloir signifier. Si je transpose ce phénomène à la nature, c’est grâce à l’explication claire que j’en ai trouvée dans le fort volume de Trin Xian Thuan, Le chaos et l’harmonie[6]Le chaos et l’harmonie, Fayard, 1998.. En réalité, le saut quantique, introduit par Niels Bohr, suite aux travaux de Ernest Rutherford (modèle planétaire des atomes) et Max Planck (découverte des quanta), est simplement l’appellation de l’explication de phénomènes quantiques ; ce n’est pas en soi le phénomène. De fait, transposé au monde du vivant, il me permet de décrire un changement d’état aussi, mais sans véritablement m’expliquer comment ce changement est possible. C’est ici l’une des limites ou des forces de l’épistémologie, et le recours à la métaphore, et donc la validité de la part imaginaire, permet d’en tirer parti.
Ce concept n’est d’ailleurs pas véritablement nouveau : il est similaire au précepte, formalisé par la Gestalt-Theorie, selon lequel le tout est supérieur à la somme des parties. Ainsi, on sait qu’un être vivant est une réalité diverse que la somme des organes qui le composent. Ces organes sont une réalité diverse que la somme des cellules qui le composent. Et ainsi de suite jusqu’aux atomes, eux-mêmes constitués de particules encore inférieures.
De la même manière, on sait qu’une forêt, par la force du nombre, représente une sorte de métaorganisme (qui nous rappelle le super organisme de Frederic Clements[7]Voir Les deux (ou trois) écologies, ci après. qui sans doute avait entrevu cette capacité du vivant), mieux résistant aux aléas climatiques, produisant éventuellement son micro-climat, communiquant, d’une manière ou d’une autre, par exemples les individus d’une espèce entre eux pour ne pas se concurrencer (la timidité chère à Francis Hallé) ou les pesèces entre elles dans leur lutte pour la lumière ou, autre exemple avec la rhizosphère associée, etc. De même, il est évident que, pour faire face à la voracité du prédateur, nombre d’espèces, généralement herbivores, ont misé sur le multiple : le banc d’anchois, le troupeau de zèbres ou de zébus, la volée d’étourneaux, l’essaim de moucherons…
Ainsi quelque force, mal comprise encore, « pousse » les individus en foules ou sociétés dans l’optique de la survie, non pas du plus grand nombre (ce qui serait absurde) mais de l’espèce en tant que telle.
Cela est bien visible au sein d’un individu quelconque (d’une espèce quelconque) : autonome, il l’est, pour ce qui concerne son propre bien-être ; mais il est aussi déterminé, par la pulsion de vie (allez la définir !), qui l’amène, de toute manière, à se reproduire. (Le phénomène est perceptible à notre échelle, dans l’autre sens : autonomes, nous menons notre vie, sans avoir conscience de « faire » battre le cœur, de nous « faire » tenir debout, de nous « faire » digérer : une autre « entité » s’en charge.)
Mon interrogation surgit ici : comment se fait-il, dit autrement, qu’il y ait de l’espèce dans l’individu ? Dans ce même individu, comment se fait-il que des atomes, les mêmes atomes que les objets célestes et inanimés, puissent former des cellules, les cellules des organes et les organes un organisme (je saute des niveaux volontairement).
À un niveau supérieur, je me demandais si, en sus des sociétés, composées généralement d’une même espèce, les assemblages que met au jour l’écobiocénotique, et que la phytosociologie a largement repérés : la pelouse à Fétuque et Brome, la forêt inondée à Aulne glutineux, les falaises siliceuses méditerranéennes à Fougère laineuse et Diplachné tardive, etc., présentaient aussi cette faculté du tout supérieur aux parties : dans le cas des cénoses, en fait, cela est même l’évidence, puisqu’un organisme supérieur, une synespèce, composés elle-même d’espèces indépendantes, représente une entité avec sa propre autonomie (et son propre déterminisme) !
J’appelle ainsi « saut quantique » l’élément de discontinuité naturelle qui fait passer d’une holosystème (un système en l’état, total) à un autre, typiquement :
- de l’atome à la cellule ;
- de la cellule à l’organisme ;
- de l’organe à l’organisme ;
- de l’organisme à la population/société/foule ;
- de l’individu à l’espèce ;
- et ainsi de suite.
Il y a une relation d’intégration, plus un surplus d’information, qui est probablement dû à la transformation quantique des énergies accouplées. On note aussi que le passage d’un tout à un autre se fait à travers une dimension singulière du réel, le plus souvent, un vide, une béance (de quelle nature est le monde entre deux orbites électroniques ? De quelle nature est le monde entre les différents organes reliés entre eux et l’individu ?). (Ici d’ailleurs faudrait-il faire un signe au concept d’entropie, fortement lié au temps et à l’espace, bien entendu, et à l’énergie, mais je suis trop peu à l’aise avec le concept, ou lui avec moi, pour exprimer simplement ce que je pourrais imaginer.)
Dit autrement encore, le saut quantique est le phénomène naturel qui permet le passage d’une réalité ontologique à une autre. Un tout devient une partie d’un tout supérieur (au sens d’intégré). Il équivaut au passage du vide à la matière, et de la non-vie à la vie, du « dedans » que représente le vivant au « dehors » de tout l’univers.
C’est lorsque la forme devient la fonction, et la fonction la structure. Quand l’habitant devient l’habitat. C’est le vide qui gît entre chacune des gigognes du monde et permet que quelque chose comme la gigogne puisse être : c’est une déclination du pli. C’est la dimension fractale. C’est le compte logarithmique. Quand la cause devient conséquence. Le ligne droite la courbe. Le facteur x comme mesure.
C’est la vie, au sens où, dans le vide de l’univers, c’est l’unique moyen (et l’unique expérience) de la réversibilité, ce que le temps pré-quantique interdit absolument, et qui a donc également tout à voir avec la mort.
Le biome
Il m’était nécessaire de passer ce détour pour préciser ici ma conception du biome – mais il était utile également de le placer dans ces premières pages, puisqu’il a évidemment des conséquences sur la conception du vivant (chapitre 2) et par conséquent de l’histoire de l’écologie (chapitre 4).
Revenons d’abord sur le terme que je viens d’utiliser : biome. Ce n’est pas un terme très satisfaisant à mon avis, mais passons. C’est le botaniste américain Frederic Clements, dont on parlera beaucoup bientôt, qui l’a utilisé la première fois en 1916[8]Frederic Clements, Plant succession : an analysis of the development of vegetation, Carnegie Institution of Washington, 1916..
Ces grandes entités plus ou moins abstraites mais très familières définissent des lieux géographiquement étendus, répétés en différents points du globe : de vastes ensembles de milieux similaires par leurs structures ou les fonctions. Nous les connaissons tous : la taïga, la toundra, la forêt tempérée, la prairie ou la steppe, etc.
Une première clef dichotomique, on l’a vu, serait de distinguer les milieux marins des milieux terrestres ou continentaux. Le milieu marin pourrait être divisé sur le même principe que le milieu terrestre, sur la base des végétaux, mais d’autres traditions sont en cours, pour d’évidentes raisons, qui s’intéressent à l’altitude (la profondeur) qui est cause de la dispersion de la lumière et donc de la vie, végétale d’abord, puis animale. Les milieux terrestres portent également un système aquatique aérien et souterrain, cyclique, généralement complexe, d’eau douce.
On peut ensuite séparer de grandes « formations » qui sont définis, physiognonomiquement, par les structures végétales pérennes qu’on y trouve – qui diffèrent au besoin par leur composition, mais présentent les mêmes qualités structurelles : ce sont des milieux, au même titre que le lac ou la grotte, à la différence qu’ils sont eux-mêmes organiques : la prairie, la forêt, etc.
C’est évidemment une source de confusion entre l’habitat et l’organisme qui y vit, surtout si cet organisme est un végétal, et plus encore s’il est constituant de l’habitat lui-même. Cette confusion, toujours d’actualité, pose toute une série de problèmes que nous tâcherons de voir par la suite : primat des sciences phytogéographiques sur les sciences zoogéographiques, problème de la vagilité (capacité de se déplacer relativement rapidement, parfois sur de longues distances, des animaux), confusion entre syntaxon phytosociologique et habitat.
Les grandes « formations végétales » sont au nombre de quatre, cinq, six, sept ou huit selon les auteurs : très prosaïquement et schématiquement, on peut distinguer le désert et les systèmes rocheux nus, les pelouses ou systèmes herbacés, y compris la toundra, les prairies ou système herbacés enrichis, les matorrals, garrigues, landes et toutes formations buissonnantes basses, et les forêts. Les milieux de contact entre l’eau et la terre sont toujours difficiles à situer : les littoraux marins présentent des similarités avec les littoraux lacustres, n’était le degré de salinité de l’air et de l’eau, mais les littoraux présentent également des affinités avec les sables intérieurs, avec les pelouses rases… En outre la plupart des zones humides : marais, tourbières, ripisylves, forêts inondées ou mangroves, sont souvent des milieux mixtes qui en vérité seraient à rattacher simultanément à l’un ou l’autre système.
Les biomes ont une évidente répartition zonale (latitudinale), ce qui peut être une autre clef dichotomique, au même titre d’ailleurs que l’altitude, et donc l’exposition. Ensuite c’est une balance subtile entre différents facteurs biotiques et abiotiques qui permet le détail jusqu’aux grandes unités cénologiques classiques. Le lien au climat apparaît comme central, et donc dépendant de toute une série de causes astrophysiques et cosmologiques, mais aussi géodésiques et géophysiques, sur lesquelles je ne m’appesantirai pas.
La structuration des biomes entre eux est donc le fruit d’une observation aiguë, d’abord à charge des premiers biogéographes, comme Alexander von Humbolt, notamment dans son imposant Cosmos[9]Cosmos. Essai d’une description physique du Monde (1847-1859], Utz, 2000.. Le premier qui propose une légende biogéographique est Grisebach, déjà cité, qui le premier d’ailleurs parle de « formation ». Il désigne ainsi une cinquantaine de formations végétales.
Avec le développement des explorations, principalement de la part des Européens dans leurs colonies, les progrès des techniques de la mesure, et la vogue de la géographie, bien vite les cartes mondiales de végétations s’accumulent. Si Fosberg et Pearsall III[10]Raymond Fosberg, Sam H Pearsall, « Classification of non-marine ecosystems », in Atoll Research Bulletin n°389, p.1-38, 1993., dans un texte synthétique, retiennent quelques noms en particulier sur lesquels nous reviendrons ci-après, August William Küchler, géographie américain d’origine allemande, publie une imposante International bibliography of vegetation maps[11]International bibliography of vegetation maps, University of Kansas Libraries, 1965-1970. qui recense ces tentatives pour chacun des continents et pour le monde dans cette dernière catégorie (on en compte pas moins de quarante-neuf entre 1866 et 1968 !) La dernière, non des moindres, de Josef Schmithüsend, énumère dans Das Grosse Dudenlexikon, une compilation de 144 divisions[12]Vegetation maps at 1:25 million of Europe, North Asia, South Asia, SW Asia, Australia, N Africa, S Africa, N America, Central America, South America (north part), South America (south part) in … Continue reading.
Les tentatives les plus intéressantes (complètes, pertinentes, originales) étant celles de Grisebach, donc, en 1866 (la première), Richard Andree en 1901 (dix zones, ouvrage très simple et clair), Adolf Engler et Oscar Drude en 1902, Heinrich Brokmann-Jerosch en 1919, puis publié en 1930 et en 1937, August Hayek en 1926, Andreas Schimper, évidemment, en 1935, August Küchler lui-même, très détaillée avec 35 formations dans la version de 1960, Heinz Ellenberg en 1957, Evgueni Mikhaïlovitch Lavrenko en 1954 (soviétique), John Philipps en 1959 (pour les Tropiques et Subtropiques), Pierre Ozenda (pour le système alpin) en 1964, Vitor Sochava en 1964 enfin, extrêmement détaillée également (98 types séparés en sept groupes).
Le référentiel qui a séduit le plus étant celui des « zones de vie » (life-zones) de Leslie Holdrige[13]Leslie R. Holdridge, « Determination of world plant formations from simple climatic data », in Science n° 105/2727, p.367-368, 1947 ; id., Life zone ecology, San José, Costa Rica, Tropical … Continue reading qui définit 38 classes d’associations au sein d’un système objectif et relativement simple décrivant les relations entre trois facteurs, les précipitations (annuelles), la température (moyenne annuelle) et l’évapotranspiration potentielle, à quoi peuvent s’ajouter l’humidité, la latitude, l’altitude. Abondamment réutilisée, largement actualisée, cette classification est fort prisée pour décrire les phénomènes du dérèglement climatique.
De la même manière, la classification de Heinrich Walter (puis Walter & Siegmar-W Breckle[14]Heinrich Walter, Die ökologischen Systeme der Kontinente (Biogeosphäre). Prinzipien ihrer Gliederung mit Beispielen, Gustav Fischer, 1976 ; Heinrich Walter, Siegmar-W. Breckle, Ökologie der Erde, … Continue reading), également largement utilisée, propose en plus des classes de biomes (qui sont, grosso modo, proches des grands types de climats mis en évidence, par exemple, par Whittaker[15]op.cit.), les zonobiomes.
Le tableau suivant essaie de montrer les corrélations entre les systèmes aujourd’hui les plus connues et reconnus.
| Holdridge 1947 | Allee 1949[16]Warder Clide Allee, Principles of Animal Ecology. Philadelphie, W.B. Saunders Co., 1949. | Kendeigh 1961[17]Samuel Charles Kendeigh, Animal Ecology, Englewood Cliffs, Prentice Hall, 1961. | Whittaker 1962-1975 | Walter 1976-2002 | Global 200 |
|---|---|---|---|---|---|
| 8. forêt humide | 7. forêt tropicale | 9.forêt pluviale | 1. forêt pluviale tropicale | 1. forêt pluviale | 1. forêt pluviale |
| 9. forêt pluviale | 3. forêt de conifères tropicales et subtropicales | ||||
| 7. forêt tempérée | 3. forêt tempérée | 1. forêt décidue tempérée | 2. forêt pluviale tempérée | 5. forêt pluviale tempérée | |
| 3. forêt décidue tempérée (« forêt saisonnière tempérée) | 4. forêt tempérée | ||||
| 5. forêt de conifères tempéré | |||||
| 11. forêt aride ? | 8. savane | 4. savane et forêt saisonnière tropicale | 2. forêt de mousson, savane et forêt saisonnière tropicale | 2. forêt aride | |
| 12. forêt très aride | 7.prairie, savane et landes tropicales et subtropicales | ||||
| | 3. bois | 5. lande et bois | |||
| 4. lande | 8. lande méditerranéenne | 4. lande méditerranéenne | 4. végétation sclérophytqiue | 12. forêt bois et lande méditerranéenne | |
| 5. lande aride | |||||
| 6. lande-désert | |||||
| 10. steppe ? | 4. prairie | 6. prairie | 6. prairie tempérée et désert froid | 6. prairie et désert froid | 8.prairie, savane et lande tempérée |
| 1. désert | 5. désert | 7. désert | 7. désert subtropical | 3. désert (subtropical aride) | 13. désert et lande xérophile |
| 2. taïga | 2. taïga | 8. taïga (« forêt boréale ») | 7. taïga | 6. taïga | |
| 2. toundra | 1. toundra | 5. toundra | 9. toundra | 8. toundra | 11.toundra |
| 3. toundra aride | |||||
| | 6. haute-montagne | 10. prairie et boisement de montagnes | |||
| | 9. biomes terrestres mineurs | ||||
| | 9. prairie et savanes inondables | ||||
| | 14. mangroves | ||||
| | calotte polaire | ||||
| | |||||
| | Marins | ||||
| | plancton et nekton | ||||
| | balanoïdes, gastéropodes et tallophytes | ||||
| | palecipodes et annélides | ||||
| | barrière coralline | 5. barrière coralline | |||
| | 1. zone polaire | ||||
| | 2. plateforme continentale | ||||
| | 3. zone de remontée d’eau, tempérée | ||||
| | 4. id., tropicale | ||||
| | |||||
| | EAUX DOUCES[18]Ici, deux classifications existent, de sources différentes, et je n’indique que la version à 7 biomes (l’autre, que je trouve d’ailleurs un peu détaillée), en a 12. | ||||
| | 1. grands fleuves | ||||
| | 2. Amont des grands bassins fluviaux | ||||
| | 3. deltas des grands fleuves | ||||
| | 4. Cours d’eau moyens | ||||
| | 5 ?. grands lacs | ||||
| | 6.petits lacs | ||||
| | 7.bassin xériques |
Ce tableau indigeste permet de noter que selon l’appréciation initiale, le point de vue, l’ordination des biomes change.
On trouvera d’ailleurs, dans l’une des plus récentes tentatives de classifier les biomes, celle de Ladislav Mucina, dans une introduction théorique générale intéressante d’une nouvelle série de manuels (le premier concernant l’hémisphère sud), une synthèse des différentes approches [19]Ladislav Mucina, Biomes Ecology 1 : Biomes of the Southern Hemisphere, Springer, 2023..
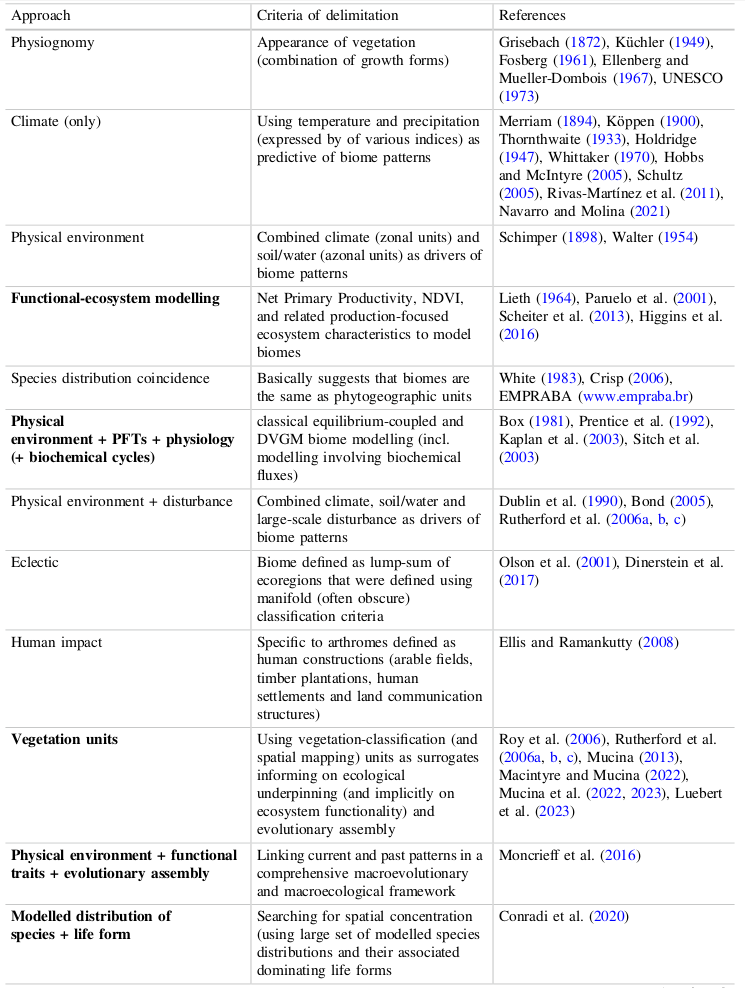
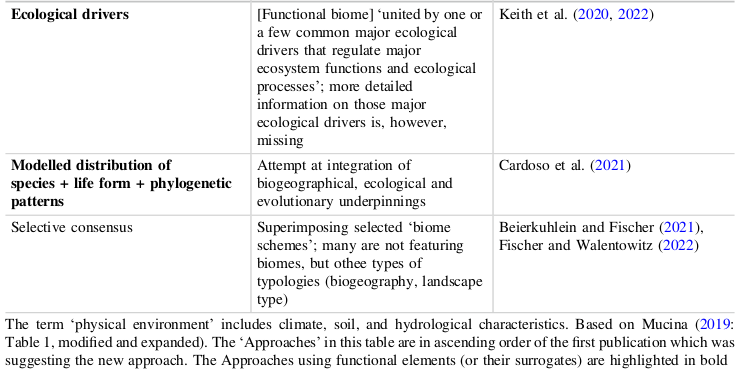
Mais ce long détour pour signifier que ce qui m’intéresse plus particulièrement ici, aux fondements de l’écologie, au moment où se déterminent et se cristalisent méthodes et concepts, et où donc se prennent des voies qui ne verront pas de retour possible, la description des biomes, pour fascinante qu’elle demeure, n’en reste pas moins une approche géographique. Elles ne traitent des cénoses qu’à la marge, en tant que les formations végétales, genre d’organismes complexes, sont également des habitats. Et toutes ne prennent pas en compte toute une série de ce qu’il faut bien nommer des habitats même si ce ne sont pas des formations végétales. La plupart des habitats du vivant (airs, océans, déserts, grottes) ne sont pas structurés par les végétaux, sans même parler de la rhizosphère ou du microbionte généralisé (tous les habitats endointestinaux).
Ainsi, dans le cadre des biochores de Dansereau déjà cité, je reviendrai plus particulièrement sur deux propositions que je trouve extrêmement pertinentes, et qui sont malconnues, et qui pourtant me paraissent illustrer une piste de recherche valide. Pour ce qui m’intéresse plus particulièrement dans ces pages, c’est-à-dire les fondements de l’écologie, les grandes divisions qui comprennent le vivant (les formations végétales) sont celles qui me paraissent les plus enrichissantes, comme celles d’Ozenda ou d’Ellenberg.
Le Canadien A. Brooker Klugh propose en 1923 un « système pratique (common) de classification en écologie végétale et animale[20]A. Brooker Klugh, « A Common System of Classification for Plant and Animal Ecology » , in Ecology n°4, p.367-377. ». Constatant la grande confusion qui règne déjà à son époque (et citant un grand nombre d’auteurs, dont une bonne partie de ceux que nous avons cités – jusqu’à 1923 évidemment), il souhaite, lui, proposer un système qui soit à la fois mondial et global, c’est-à-dire comprenant à la fois les végétaux et les animaux.
Klugh regrette (à juste titre) le conflit entre les points de vue des zoologues et des botanistes, et soulignant que cette discussion se concentre sur la distinction entre succession et habitat[21]Une vaste discussion entrevue dans le chapitre suivant, Les deux (ou trois) écologies., c’est-à-dire entre la considération d’un tout dans sa dynamique ou bien à un moment donné, ou encore entre climax et biome (tous deux termes introduits par Clements[22]On note la confusion entre climax et biome sur la carte du WWF reproduite ci-dessous : une grande partie de l’Europe continentale représente la forêt de feuillus, mais où sont les plaines … Continue reading). Toutefois l’habitat semble mieux indiqué, pour ce que, s’il est un concept évident aux yeux des botanistes, Klugh cite de nombreux zoologues l’ayant eux-mêmes adopté (retenons les noms de Shelford, Adams ou Dice).
Finally it may be said in favor of the habitat rather than succession as the basis of ecological classification that it is better to have a classification based on realities which may be used to build up probabilities than a classification based on probabilities into which realities must be fitted. (368)
Je passe sur les différences de terminologie qui font le charme de la biocénotique (chapitre 5) ; je note en passant l’intéressante question de savoir comment nommer ces habitats, si la nomenclature doit se fonder sur le grec ou non. La liste est longue et détaillée, je ne cite ici que les « associations », qui se trouvent être au nombre de trente.
- Pelagic Association.-The Water of the Ocean.
- Benthic A.-The Sea-bottom.
- Littoral A.-(Actic A.) The Sea-shore between the tide-marks.
- Tide-pool A.-(Clysotremic A.)
- Estuarine A.-(Ecronic A.)
- Upper Estuarine. (Oligohalile S.) The part of the estuary in which the total salt
- Alkaline Lake A.-(Drimic A.)
- Temporary Stream A.-(Metanamic A.)
- Spring A.-(Crenic A.) Springs and the water of their brooks adjacent to source.
- Stream A.-(Potamic A.)
- Hot-spring A.-(Thermopegic A.)
- Lake-Bottom A.-(Pythmic A.)
- Pond A.-(Tiphic A.)
- Pladopetric A.-Rocks moistened by dripping water.
- Temporary Pool A.-(Ombrotiphic A.) Temporary pools left by melting snow and spring rains.
- Salt Marsh A.-(Limnodic A.)
- Marsh A.-(Helic A.)
- Swale A.-(Helodric A.) Swamp-thickets.
- Peat-bog A.-(Oxodic A.)
- Forest A.-(Hylic a.)
- Grassland A.-(Poic A.)
- Heath A.-(Sterric A.) An upland assn. characterized by Ericaceous shrubs, xerophytic grasses and lichens.
- Alpine Heath A.-(Orothamnic A.)
- Tundra A.-(Crymic A.)
- Snow-field A.-(Chionic A.) Snow-fields and glaciers.
- Strand A.-(Agic A.)
- Rock-slide A.-(Sphyric A.)
- Dry Rock A.-(Petric A.)
- Dune A.-(Thinic A.)
- Desert A.-(Eremic A.)
mais alors
La liste des items est trop longue pour être détaillée ici, mais on soulignera que Kuhl rejette le terme de formation, trop ambigu à son époque, et retient en revanche celui d’association, dans la définition de Flahaut et Schröter du Congrès de Bruxelles (1910), mais étendue au monde animal : « An association, affirme-t-il, is a community of definite biotic composition living in uniform habitat conditions. » (369). Il distingue les associes, leur correspondant dynamique (comme il était d’usage à l’époque), il introduit en outre le terme de systasis pour deux groupements coexistants qui ne parviennent pas à s’ériger en association. Les associations composées d’une seule espèce sont des consociation (avec son correspondant consocies), hérité de Clements, encore. Il réserve le terme de cénose (s’appuyant sur son créateur, Möbius) pour un groupement dominant au sein d’une association – ce qui diffère alors de notre propre définition de la cénose (voir le chapitre suivant).
Autre point notable, si l’on considère le détail d’une seule de ces associations (les forêts), on note également aux côtés de la cénose la strate, directement héritée (probablement) de Raunkiaer mais aussi d’Helmut Gams[23]Helmut Gams, « Prinzipienfragen der Vegetationsforschung. Ein Beitrag zur Begriffsklärung und Methodik der Biocoenologie. Vierteljahrsschr », in Naturforschende Gesellschaft in Zürich n°63, … Continue reading : ici donc il y a différenciation des strates comme sous-habitats, mais équivalentes à des cénoses, par exemple celles du bois mort ou du tronc.
- Forest A.-(Hylic a.)
- Wet Forests. (Hygrohylile Systasis.)
- Subterranean Stratum.
- Herb Stratum.
- Decaying-log C.
- Shrub Stratum.
- Tree-trunk Stratum.
- Living-trunk C.
- Dead-trunk C.
- Tree-top Stratum.
- Moist Forests. (Mesohylile S.)
- Strata and cenoses as above.
- Thicket Associes. (Mesolochmis.)
- Dry Forests. (Carphohylile S.)
- Strata and cenoses as above.
- Thicket Associes. (Carpholochmis.)
- Subalpine Forests. (Orohylile S.)
- Strata and cenoses as above.
- Thicket Associes. (Orolochmis.)
Quelques années plus tard, en 1929, l’Espagnol Huguet del Villar, propose une classification originale[24]Emili Huguet del Villar, Geobotanica, Labor, 1929., probablement la plus complexe (au sens de « la plus intégrative possible ») jusque ici. Le mérite revient à Dansereau de l’avoir mondialement faite connaître – le texte original étant passé relativement inaperçu. Ecoutons Dansereau :
In his approach to environments, he rejects all floristic, sociological, geographic, physiognomic, and successional criteria as such. The mainstay of his system is the idea of harmony vs. discrepancy. In a harmonious habitat there is neither excess nor deficiency of any element ; therefore, none exerts a controlling influence. On the other hand, water scarcity, high and low temperatures, loose and hard soils, alkaline or acid substrata, if individually present where other factors are harmonious, create a discrepancy which becomes limiting and thus controls the habitat. (129, l’auteur souligne)
Cette vision fort originale, qui a peut-être influencé le modèle actuellement fort en vogue de la théorie adaptative de John Grime (qui ne touche pas directement la cénologie, à mon avis, mais démontre l’influence de l’écologie d’obédience américaine, ressourcielle, en cours dans la phytosociologie contemporaine[25]John Philip Grime, « Vegetation classification by reference to strategies », in Nature n°250/5461, p. 26-31, 1974.), rassemble 25 grands habitats, en n’omettant pas, par exemple, l’habitat vivant (moisissures, corps animal, etc.). Cela dit, comme le souligne Dansereau, il peut également apparaître comme une version « allégée » de ce même fonctionnalisme, ou comme une réponse indirecte à Tansley[26]I.e. à son concept d’écosystème, que j’aborde dans le chapitre suivant. dans un esprit tout de même non organiciste.
Ecosystem, therefore, as defined above, is not tied to community or even to formation. It is definable in terms of site factors. A single one may contain one or more communities. (131)
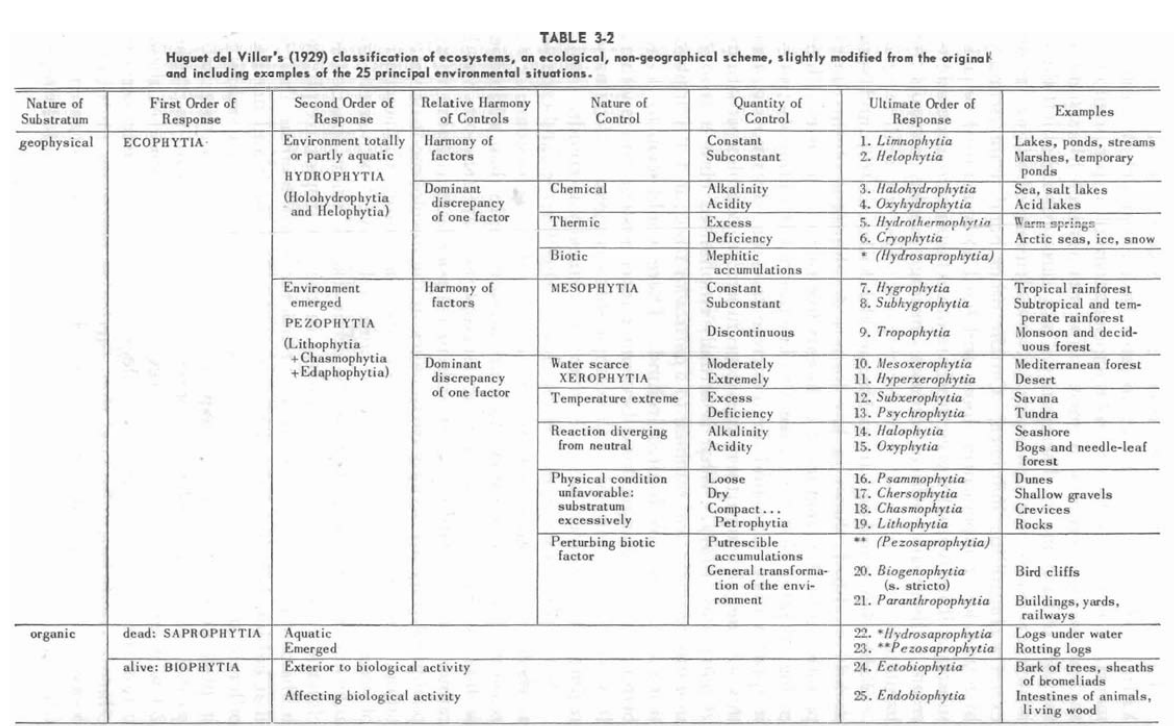
bioèce et biocène
Après cette immersion historique et épistémologique, que je tenais à citer parce qu’elles m’ont véritablement inspiré au plus haut point, il s’agit de décider alors quelle configuration donner véritablement au biome.
Un autre détour me paraît toutefois indispensable. Si l’on considère les choses à l’envers, nous ne partons pas de rien : les différentes classifications venues de la botanique existent (principalement en Europe, il est vrai), formant des prodromes en cours d’harmonisation au moins à l’échelle du continent européen. Plusieurs écoles existent, les synthèses les plus complètes étant celles de Milan Chytrý[27]Milan Chytrý, Stephan M. Hennekens, Borja Jiménez-Alfaro, Ilona Knollová, Jürgen Dengler, Florian Jansen, Flavia Landucci, Joop H.J. Schaminée, Svetlana Aćić, Emiliano Agrillo, Didem Ambarlı, … Continue reading pour les membres des différentes sociétés internationales européennes de science de la végétation (où d’ailleurs la France brille par son absence), et l’entreprise hardie et originale d’un seul homme, Philippe Julve[28]Philippe Julve, Catminat : http ://philippe.julve.pagesperso-orange.fr/catminat.htm, au niveau mondial, Catminat.
Quoi que ces classifications présentent comme qualités ou défauts, quelques différences d’interprétation ou de méthodologie qu’elles valorisent l’une par rapport à l’autre – ce n’est pas ici mon sujet – elles n’en demeurent pas moins identiques sur un point : elles considèrent en priorité, sinon uniquement, les végétations.
Lorsque je me suis penché sur les cénoses malacologiques, d’après le mot d’Häßlein cité plus haut, je me suis retrouvé comme désarçonné par le manque de corrélation entre l’habitat considéré « du point de vue de l’escargot » et celui considéré « du point de vue du phytocénologue » : d’un côté, animal, une extrême simplicité : les quatre habitats d’Häßlein ; de l’autre un syntaxosystème extrêmement détaillé, constitué de plusieurs rangs d’unités intégrées les unes dans les autres et avec, au final, près d’une centaine de classes (le rang supérieur de ces classifications) pour le seul continent européen.
Pour le dire autrement, l’escargot ne s’y retrouvait pas. Je me suis alors rappelé Dansereau et le nombre fini de « grands habitats » des différentes classifications. J’ai une certaine fascination pour les guides des milieux naturels, qui servent au technicien ou à l’amateur de clefs de reconnaissance de ces habitats, mais à un certain niveau de précision, généralement celui de l’alliance phytosociologique (idéalement le troisième rang, après la classe et l’ordre, et avant l’association). Or ceux-ci sont généralement rassemblés en grands habitats, tout comme les classes sociologiques en général, que ce soit chez Chytrỳ ou chez Julve : ce sont la forêt, par exemple (le plus « équilibré et éventuellement mature », disons pour l’instant, des habitats), qui rassemble les forêts tempérées ou les forêts de montagne, les forêts inondées, les forêts boréales ou les forêts de nuage, ces exemples simplement prix au hasard. La forêt est l’un de ces grands habitats. Avec le fourré, par exemple (ou la garrigue, ou la savane), ils forment le biochore « des milieux à matrice végétale ligneuse stratifiée », si l’on veut.
C’est à ce niveau, du grand habitat, que se joue la vie de l’escargot, pas au niveau phytosociologique ! Or ce rang supérieur n’est pas considéré par la phytosociologie. Josias Braun-Blanquet (le « cercle de végétation ») ou Haro Passarge (la « formation » ) en ont bien eu l’intuition, mais il n’y a pas réellement une tentative d’intégration au synsystème, sauf avec la « division », très à la marge.
Mais même dans ce cas, dans le cas d’un rang supérieur, il fallait bien considérer que la phytosociologie ne considérait que les phytocénoses. Bien des zoologues se retrouvent dépourvus d’unité cénotique dès qu’il s’agit d’habitats privés de végétations, et qui ne sont pas moins négligeables, tels les habitats minéraux : les grottes, mais aussi dans une certaine mesure, le sol, le cours d’eau, ou l’océan ! Du point de vue de l’escargot, un autre synsystème s’imposait (avec ses rangs, ses unités particulières) ; idem pour les collemboles, idem pour les autres animaux, et en vérité, idem pour chacune des unités taxinomiques supérieures (probablement au niveau de l’embranchement de l’ancienne systématique, mais cela pourrait aussi se discuter). Bref on se retrouverait, logiquement, avec différents synsystèmes juxtaposés, qui pourraient (ou non) former une unité supérieure, n’est-ce pas ? Ce niveau supérieur n’existe pas.
Comme il se place entre la formation (au sens classique) de la biogéographie et le rang syntaxonomique supérieur de la cénologie, j’ai pensé alors qu’il devait faire précisément, grâce au saut quantique, représenter cette interface : le biome me paraissait le mieux à même de coller, mais dans ce cas il était pratiquement inévitable que ce biome (sur le modèle de la définition classique, mais que je rejette, de l’écosystème) soit constitué de deux dimensions : la dimension biologique et la dimension géographique. Il faut bien qu’il se rattache aux synsystèmes, sinon il était déconnecté du travail du cénoticien ; et sa partie non organique permettait au géographe de le repérer facilement.
Je propose ainsi de dénommer l’ensemble des unités syntaxonomiques disponibles pour un unique biome le biocène (phytocénoses, zoocénoses, mycocénoses, etc.) : une appellation neutre (grand habitat) est nécessaire, mais le détail des différentes sous-classes nécessite un travail qui à mon avis est encore à faire (surtout pour les animaux, en particulier les animaux peu vagiles).
L’ensemble, vivant ou non, qui forme l’habitat de ce biocène, je propose de le dénommer bioèce. Pour chaque biome, un bioèce abrite un biocène. Les grands types de biomes, à leur tour, forment le biochore.
Je viens de résumer à grands traits les grandes divisions du monde, d’un point de vue géographique puis biogéographique. J’ai développé, plus précisément, de manière appliquée, ces idées dans des articles spécialisés auxquels je me permets de renvoyer le lecteur, pour plus de détails qui ne sont pas nécessaires en revanche pour la suite de ces pages. Je reproduis en revanche le tableau de biomes, tels que j’ai tâché de le concevoir dans la synthèse et le respect des différents auteurs qui m’ont précédé.
Dans ce tableau, provisoire, en construction, il est imaginé que les biochores étaient fondés sur un nom grec, tandis que les biomes l’étaient sur un nom latin. Ce n’est pas toujours évident (le latin a aussi emprunté au grec), mais c’est une proposition. On note (je le réalise après coup) que Ether correspondant à l’Atmosphère, Okeanos à l’Hydrosphère et Geos à la Lithospère ! Quant à Bios, évidemment, à la Biosphère. Ces quatre biochores primaires peuvent sans doute se diviser à nouveau, comme je l’ai proposé pour Geos : en Hélos, Xéros et Hylos : les milieux humides et ouverts, les milieux secs et ouverts, les milieux sous couvert forestier. Pour Okeanos, je suppose que cela conduirait à distinguer une zone libre de lumière (et donc de plante) et une zone libre de sol (la pleine eau). J’ajoute au dernier moment, pour le Biontoèce/Biontocène, l’habitat humain, dont je dirai un mot dans le dernier chapitre : Urbièce/Urbicène.
(Certains domaines sont incertains, pour l’instant pour moi : pour le monde marin je n’ai fait que transposer la division altimétrique, qui n’est donc pas biogéographique, mais qui est commode dans un premier temps. Il faut dire qu’une fois entré dans les eaux mortes (sans végétaux) les distinctions sont plus difficiles — et les régions moins facilement délimitées. Ce serait pourtant chose à faire. Dans un autre registre, je n’ai jamais vu la savane et je n’ai donc qu’une idée bibliographique ou cinématographique de ce qu’elle peut être. Je l’ai indiquée pour mémoire, à la place qui traditionnellement lui est réservée ; mais on ne peut je crois se satisfaire soit d’une dégradation de la forêt (comme des accrus, après une coupe ou des rejets après l’incendie), soit au contraire d’un milieu transitoire entre une steppe et la forêt. À ce titre elle me paraît partager pas mal de traits avec ce que les méditerranéens connaissent bien sous les termes de maquis et garrigue, de macchia, de matorral, de chaparral.
(Note incidente. Biome ici, échappe au terme strictement biogéographique entrevu plus haut. En vérité on pourrait associer bioèce et biocène en une unique parole, biocole — et ainsi de suite pour tous les dérivés : ex. paludièce/paludicène>paludicole ; le suffixe –cole, indiquant de manière assez subtile « ce qui habite » et « ce qui produit » (et également « ce qui honore »), cette subtilité rendant bien la difficulté de ne pas pouvoir séparer les deux « faces » de la même « feuille ». Ces notions sont encore à discuter.)
| Biochores | Biocoles | |||||
| Bioèces | Biocènes | |||||
| 0.ETHER | Célièce | 0. Célicène | ||||
| 1.OKEANOS | A. Marièce | A1. Hadal | A. Maricène | |||
| A2. Abyssal | ||||||
| A3. Bathyal | ||||||
| A4. Circalittoral | ||||||
| 2. GEOS |
HELOS | B. Littorièce | B1. Infralittoral | B. Littoricène | ||
| B2. Mediolittoral | ||||||
| B3. Supralittoral | B3. Supralittoral | B3a. Scopulicène | ||||
| B3b. Thimiicène | ||||||
| C. Acquièce | C1. Stygoèce | C1. Stygocène | C. Acquicène | |||
| C2. Crenièce | C2. Crénicène | |||||
| C3. Potamièce | C3. Potamicène | |||||
| C4. Limnièce | C4. Limnicène | |||||
| D. Paludièce | D. Paludicène | |||||
| XEROS | E. Pétrièce | E1. Cavernièce | E1. Cavernicène | E. Pétricène | ||
| E2. Vrachièce | E2. Vrachicène | E2a. Glaréicène | ||||
| E2b. Rupicène | ||||||
| E2c. Lapidicène | ||||||
| E2d. Sabulicène | ||||||
| E2e. Glacicène | ||||||
| E3. Géièce | E3. Géicène | |||||
| F. Herbièce | F1. Steppièce | F1. Steppicène | F1a. Toundra | F. Herbicène | ||
| F1b. Savane | ||||||
| F2. Pratièces | F2. Praticène | |||||
| HYLOS | G. Lucquièce | G1. Dumétièce | G1. Duméticène | G. Lucquicène | ||
| G2. Maculièce | G2. Maculicène | |||||
| G3. Agrièce | G3. Agricène | |||||
| H. Silvièce | H1. Taïga | H1. Taïga | H. Silvicène | |||
| H2. Pampinoèce | H2. Pampinocène | |||||
| H3. S-virentièce | H3. S-virenticène | |||||
| H4. Jungle | H4. Jungle | H4a. Ombricène | ||||
| H4a. Tropicène | ||||||
| X.BION | J. Biontoèce | J. Biontocène | ||||
| K. Urbièce | K. Urbicène | |||||
[Cap au seuil|Sommaire rapide] Avant propos | espace | la vie | monde | les écologies | cénologie | sciences naturelles | interlude | protection de la nature | arbres | anthropocène | catastrophe | herbier/coquillier | ouverture : régions naturelles
La vie < Terraqué le monde (2) > Deux (ou trois) écologies
References
| ↑1 | August Grisebach, « Die Vegetations-Gebiete der Erde, übersichdich zusammengestellt » , in Petermann’s Geographische Mittheilungen n°12/3, post p. 744, 1866 August Grisebach, Die Vegetation der Erde nach ihrer klimatischen Anordnung : ein Abriss der vergleichenden Geographie der Pflanzen, 2 volumes, Leipzig, Engelmann Verlag; Augustin [vol. 1-7], puis Alphonse [vol. 8-12] Pyrame de Candolle, Prodromus Systematis Naturalis Regni Vegetabilis : sive, enumeratio contracta ordinum generum specierumque plantarum huc usque cognitarum, juxta methodi naturalis normas digesta, Treuttel et Würtz, 1824-1873 [1874] : il y distingue l’hékistotherme (toundra) ; le microtherme (forêt tempéré de l’hémisphère nord) ; le mesotherme (forêts chaudes de feuillus et climat méditerranéen ; le climat xérophile (des déserts et des pelouses sèches) ; enfin le mégatherme (forêts pluvieuse tropicale et savane) ; Wladimir Köppen, Das geographische System der Klimate, Borntraeger, 1936 ; Rudolf Geiger, Überarbeitete Neuausgabe von Geiger, R. : Köppen-Geiger, Klima der Erde, Klett-Perthes, 1961. |
|---|---|
| ↑2 | Miklos D.F. Udvardy, « A Classification of the Biogeographical Provinces of the World. Prepared as a contribution to UNESCO’s Man and the Biosphere Programme, Project No. 8. », IUCN Occasional Paper n° 18, 1975. |
| ↑3 | David Olson & Eric Dinerstein, « The Global 200: A representation approach to conserving the Earth’s most biologically valuable ecoregions », in Conservation Biology n°12, pp. 502–515, 1998 ; David Olson, Eric Dinerstein et al., « Terrestrial Ecoregions of the World: A New Map of Life on Earth: A new global map of terrestrial ecoregions provides an innovative tool for conserving biodiversity », in BioScience, n°51/11, p.933–938, 2011 ; Eric Dinerstein, David Olson et al., « An Ecoregion-Based Approach to Protecting Half the Terrestrial Realm », in BioScience. n° 67/6, p.534-545, 2017. |
| ↑4 | Pierre Dansereau, Biogeography. An Ecological Perspective, Ronald Press Co., 1957. |
| ↑5 | Marc-André Selosse, L’origine du monde, Actes Sud, 2021 ; voir Jean Garbaye, La symbiose mycorhizienne. Une association entre les plantes et les champignons, Quae, 2013. |
| ↑6 | Le chaos et l’harmonie, Fayard, 1998. |
| ↑7 | Voir Les deux (ou trois) écologies, ci après. |
| ↑8 | Frederic Clements, Plant succession : an analysis of the development of vegetation, Carnegie Institution of Washington, 1916. |
| ↑9 | Cosmos. Essai d’une description physique du Monde (1847-1859], Utz, 2000. |
| ↑10 | Raymond Fosberg, Sam H Pearsall, « Classification of non-marine ecosystems », in Atoll Research Bulletin n°389, p.1-38, 1993. |
| ↑11 | International bibliography of vegetation maps, University of Kansas Libraries, 1965-1970. |
| ↑12 | Vegetation maps at 1:25 million of Europe, North Asia, South Asia, SW Asia, Australia, N Africa, S Africa, N America, Central America, South America (north part), South America (south part) in Grosses Duden-Lexikon . XVIII:321-346, Mannheim, Bibliographisches Institut A. G., 1968. |
| ↑13 | Leslie R. Holdridge, « Determination of world plant formations from simple climatic data », in Science n° 105/2727, p.367-368, 1947 ; id., Life zone ecology, San José, Costa Rica, Tropical Science Center, 1967. |
| ↑14 | Heinrich Walter, Die ökologischen Systeme der Kontinente (Biogeosphäre). Prinzipien ihrer Gliederung mit Beispielen, Gustav Fischer, 1976 ; Heinrich Walter, Siegmar-W. Breckle, Ökologie der Erde, Band 1, Grundlagen, 1991. |
| ↑15 | op.cit. |
| ↑16 | Warder Clide Allee, Principles of Animal Ecology. Philadelphie, W.B. Saunders Co., 1949. |
| ↑17 | Samuel Charles Kendeigh, Animal Ecology, Englewood Cliffs, Prentice Hall, 1961. |
| ↑18 | Ici, deux classifications existent, de sources différentes, et je n’indique que la version à 7 biomes (l’autre, que je trouve d’ailleurs un peu détaillée), en a 12. |
| ↑19 | Ladislav Mucina, Biomes Ecology 1 : Biomes of the Southern Hemisphere, Springer, 2023. |
| ↑20 | A. Brooker Klugh, « A Common System of Classification for Plant and Animal Ecology » , in Ecology n°4, p.367-377. |
| ↑21 | Une vaste discussion entrevue dans le chapitre suivant, Les deux (ou trois) écologies. |
| ↑22 | On note la confusion entre climax et biome sur la carte du WWF reproduite ci-dessous : une grande partie de l’Europe continentale représente la forêt de feuillus, mais où sont les plaines céréalières ? et quid de toutes les formations climaciques localisées, roches, marais, ripisylves, sommets alpins, etc. : elles ne sont tout bonnement pas représentées. |
| ↑23 | Helmut Gams, « Prinzipienfragen der Vegetationsforschung. Ein Beitrag zur Begriffsklärung und Methodik der Biocoenologie. Vierteljahrsschr », in Naturforschende Gesellschaft in Zürich n°63, 293-493, 1918. |
| ↑24 | Emili Huguet del Villar, Geobotanica, Labor, 1929. |
| ↑25 | John Philip Grime, « Vegetation classification by reference to strategies », in Nature n°250/5461, p. 26-31, 1974. |
| ↑26 | I.e. à son concept d’écosystème, que j’aborde dans le chapitre suivant. |
| ↑27 | Milan Chytrý, Stephan M. Hennekens, Borja Jiménez-Alfaro, Ilona Knollová, Jürgen Dengler, Florian Jansen, Flavia Landucci, Joop H.J. Schaminée, Svetlana Aćić, Emiliano Agrillo, Didem Ambarlı, Pierangela Angelini, Iva Apostolova, Fabio Attorre, Christian Berg, Erwin Bergmeier, Idoia Biurrun, Zoltán Botta-Dukát, Henry Brisse, Juan Antonio Campos, Luis Carlón, Andraž Čarni, Laura Casella, János Csiky, Renata Ćušterevska, Zora Dajić Stevanović, Jiří Danihelka, Els De Bie, Patrice de Ruffray, Michele De Sanctis, W. Bernhard Dickoré, Panayotis Dimopoulos, Dmytro Dubyna, Tetiana Dziuba, Rasmus Ejrnæs, Nikolai Ermakov, Jörg Ewald, Giuliano Fanelli, Federico Fernández-González, Úna FitzPatrick, Xavier Font, Itziar García-Mijangos, Rosario G. Gavilán, Valentin Golub, Riccardo Guarino, Rense Haveman, Adrian Indreica, Deniz Işık Gürsoy, Ute Jandt, John A.M. Janssen, Martin Jiroušek, Zygmunt Kącki, Ali Kavgacı, Martin Kleikamp, Vitaliy Kolomiychuk, Mirjana Krstivojević Ćuk, Daniel Krstonošić, Anna Kuzemko, Jonathan Lenoir, Tatiana Lysenko, Corrado Marcenò, Vassiliy Martynenko, Dana Michalcová, Jesper Erenskjold Moeslund, Viktor Onyshchenko, Hristo Pedashenko, Aaron Pérez-Haase, Tomáš Peterka, Vadim Prokhorov, Valerijus Rašomavičius, Maria Pilar Rodríguez-Rojo, John S. Rodwell, Tatiana Rogova, Eszter Ruprecht, Solvita Rūsiņa, Gunnar Seidler, Jozef Šibík, Urban Šilc, Željko Škvorc, Desislava Sopotlieva, Zvjezdana Stančić, Jens-Christian Svenning, Grzegorz Swacha, Ioannis Tsiripidis, Pavel Dan Turtureanu, Emin Uğurlu, Domas Uogintas, Milan Valachovič, Yulia Vashenyak, Kiril Vassilev, Roberto Venanzoni, Risto Virtanen, Lynda Weekes, Wolfgang Willner, Thomas Wohlgemuth, Sergey Yamalov, European Vegetation Archive (EVA) : an integrated database of European vegetation plots. in Applied Vegetation Science n°19, p.173-180. |
| ↑28 | Philippe Julve, Catminat : http ://philippe.julve.pagesperso-orange.fr/catminat.htm |
